
科目: 来源: 题型:
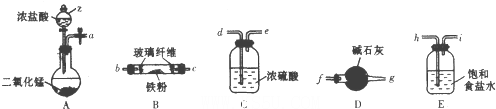
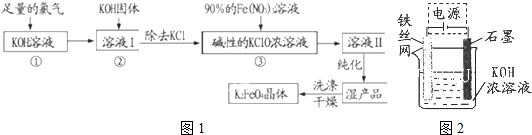
查看答案和解析>>
科目: 来源: 题型:
| 充电 |
| 放电 |
查看答案和解析>>
科目: 来源: 题型:
| A、电解精炼铜时,同一时间内阳极溶解铜的质量与阴极析出铜的质量相等 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、过程的自发性不仅能用于判断过程的方向,还能确定过程是否一定能发生 |
| D、S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;则△H1<△H2 |
查看答案和解析>>
科目: 来源: 题型:
 已知反应aA+B2=aAB,M(A)、M(B2)、M(AB)分别表示A、B2和AB的摩尔质量,其单位均为g/mol.A与B2反应的质量关系如图所示.下列说法中正确的是( )
已知反应aA+B2=aAB,M(A)、M(B2)、M(AB)分别表示A、B2和AB的摩尔质量,其单位均为g/mol.A与B2反应的质量关系如图所示.下列说法中正确的是( )| A、无法确定计量数a的大小 |
| B、M(A)=2M(B2) |
| C、M(AB)=2M(A)+M(B2) |
| D、若有6g A完全反应,则生成AB的质量为12g |
查看答案和解析>>
科目: 来源: 题型:
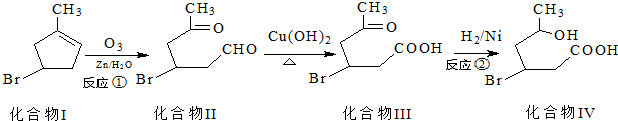
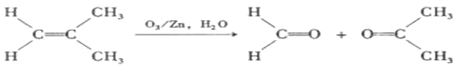
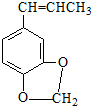 )发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为
)发生类似反应①的反应,得到乙醛和化合物Y,Y的结构简式为查看答案和解析>>
科目: 来源: 题型:
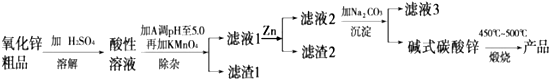
查看答案和解析>>
科目: 来源: 题型:
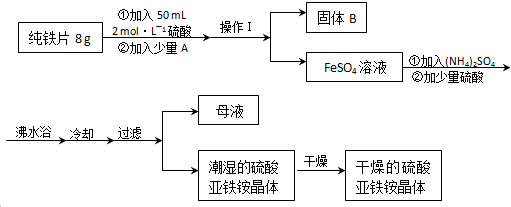
查看答案和解析>>
科目: 来源: 题型:



查看答案和解析>>
科目: 来源: 题型:
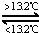 Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )
Sn(s、白)△H3=+2.1kJ/mol,下列说法正确的是( )| A、△H1>△H2 |
| B、锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |
| C、锡在常温下以灰锡状态存在 |
| D、灰锡转化为白锡的反应是放热反应 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com