
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 三氯化铁是合成草酸铁的重要原料.
三氯化铁是合成草酸铁的重要原料.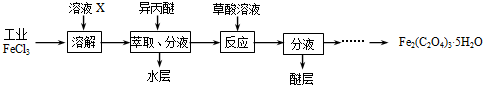
查看答案和解析>>
科目: 来源: 题型:

| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
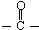 )的化合物反应生成醇,其过程可表示如下:
)的化合物反应生成醇,其过程可表示如下: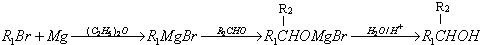 (-R1、-R2表示烃基)
(-R1、-R2表示烃基)
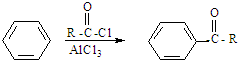
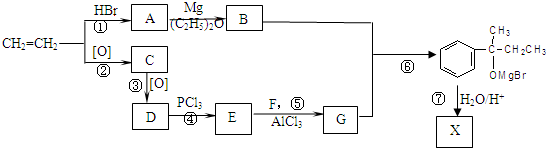
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| ||
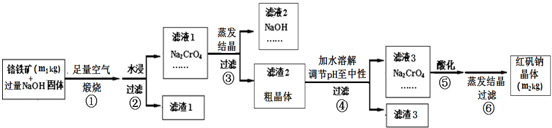
| 结晶温度/℃ | Na2CrO4粗晶中各物质含量/w% | |||
| Na2CrO4?4H2O | NaOH | Na[Al(OH)4] | Na2SiO3 | |
| 30 | 52.45 | 29.79 | 8.69 | 12.21 |
| 40 | 68.81 | 20.49 | 8.46 | 10.84 |
| 50 | 60.26 | 27.96 | 10.36 | 9.32 |
| 60 | 50.74 | 29.66 | 10.40 | 12.25 |
| 70 | 46.77 | 33.06 | 8.10 | 6.48 |
查看答案和解析>>
科目: 来源: 题型:
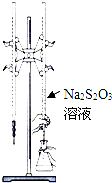 H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )
H2S2O3是一种弱酸,实验室欲用0.01mol?L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,下列说法合理的是( )| A、该滴定可用甲基橙做指示剂 |
| B、Na2S2O3是该反应的还原剂 |
| C、该滴定可选用如图所示装置 |
| D、该反应中每消耗2mol Na2S2O3,电子转移数为4mol |
查看答案和解析>>
科目: 来源: 题型:
| Fe |
| HCl |

 ”的反应中属于取代反应的是
”的反应中属于取代反应的是 中的所有原子是否在同一平面上
中的所有原子是否在同一平面上查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com