
科目: 来源: 题型:

| A、常压下五种元素的单质中W单质的沸点最高 |
| B、Z的氢化物比Y的氢化物稳定 |
| C、W元素最高价氧化物的水化物酸性比Z元素的强 |
| D、Z、W的阴离子电子层结构与R原子的相同 |
查看答案和解析>>
科目: 来源: 题型:
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
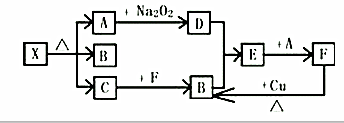
查看答案和解析>>
科目: 来源: 题型:
| 实验 | 现象 | 结论 |
| 将0.5mL浓溴水加入盛2mL苯的试管中 | ① | 苯酚分子中苯环上的氢原子比苯分子上的氢原子③ |
| 将0.5mL浓溴水加入盛2mL稀苯酚溶液的试管中 | ② |
| 乙醚 |
| 室温 |
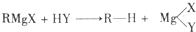 ,Y为-OH、-OR、-X(卤原子)、-NH2等.格林试剂是有机合成中用途甚广的一种试剂,它可以与羰基加成,发生反应:
,Y为-OH、-OR、-X(卤原子)、-NH2等.格林试剂是有机合成中用途甚广的一种试剂,它可以与羰基加成,发生反应: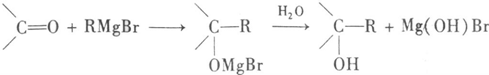
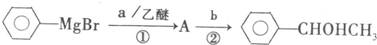

查看答案和解析>>
科目: 来源: 题型:
 实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:
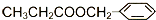 )在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:
)在食品、药品、化妆品等方面应用广泛,用烷烃A合成香精及其他两种有机物的路线如下:

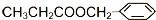 互为同分异构体的是:
互为同分异构体的是:
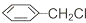 直接合成该香精,化学方程式为
直接合成该香精,化学方程式为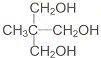 ,写出合成路线(注明条件,不要求写化学方程式)
,写出合成路线(注明条件,不要求写化学方程式)查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com