
科目: 来源: 题型:
| A、②④⑥⑦ | B、②③⑤⑦ |
| C、①③④⑤ | D、全部 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
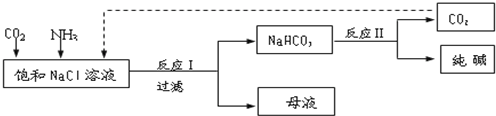
| ||

查看答案和解析>>
科目: 来源: 题型:
 A和甲是自石油和煤的两种基本化工原料,A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物,F是高分子化合物.相互转化关系如图所示(已知:R-CHO
A和甲是自石油和煤的两种基本化工原料,A是气态烃,甲是液态烃.B和D是生活中两种常见的有机物,F是高分子化合物.相互转化关系如图所示(已知:R-CHO| 氧化 |
查看答案和解析>>
科目: 来源: 题型:
| A、漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 |
| B、MgCl2是强电解质,电解氯化镁溶液可以制得镁 |
| C、生石灰能与水反应,可用来干燥氯气 |
| D、硅酸钠的水溶液俗称水玻璃,可用作木材防火剂 |
查看答案和解析>>
科目: 来源: 题型:
| A、FeCl2(FeCl3)→足量氯气 |
| B、Fe(Al)→NaOH溶液,过滤,洗涤 |
| C、MgCl2(AlCl3)→足量NaOH溶液,过滤,盐酸 |
| D、Fe2O3(SiO2)→NaOH溶液,过滤 |
查看答案和解析>>
科目: 来源: 题型:
 利用有关知识回答下列问题:
利用有关知识回答下列问题:查看答案和解析>>
科目: 来源: 题型:

| 过量稀盐酸 |
| 试剂X |
| HCl(或NaOH) |
| 调节pH |
| 水解 |
| 聚合 |
查看答案和解析>>
科目: 来源: 题型:
| A、用过滤的方法除去食盐中泥沙 |
| B、用蒸馏的方法将海水淡化 |
| C、用酒精萃取碘水中的碘单质 |
| D、用加热的方法除去碳酸钠中的碳酸氢钠 |
查看答案和解析>>
科目: 来源: 题型:
| A、乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B、乙醇(水):加入新制生石灰,蒸馏 |
| C、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D、乙酸(乙醇):加入金属钠,蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com