
科目: 来源: 题型:
| A、0.6mol NO |
| B、0.3mol NO2 |
| C、0.3molNO 0.3molNO2 |
| D、0.2molNO2 0.2molN2O4 |
查看答案和解析>>
科目: 来源: 题型:
| 滴定 次数 | 待测混合溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 27.46 | 25.90 |
| 第三次 | 25.00 | 0.32 | 26.31 | 25.99 |
查看答案和解析>>
科目: 来源: 题型:
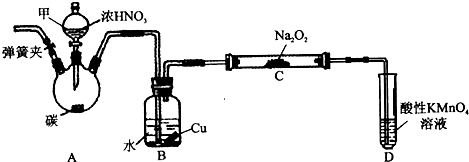
| 一系列 |
| 操作 |
| ①酸性高锰酸钾 |
| ②(NH4)2Fe(SO4)2 |
| 标准溶液滴定 |
查看答案和解析>>
科目: 来源: 题型:
| A、a+b<c |
| B、平衡向生成Z的方向移动 |
| C、Z的体积分数降低 |
| D、Y的转化率升高 |
查看答案和解析>>
科目: 来源: 题型:
| A、浓硫酸具有吸水性,因而能使蔗糖炭化 |
| B、浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 |
| C、常温下,金属铁遇浓硫酸时会在表面生成致密的氧化膜而发生钝化 |
| D、50mL 18mol?L-1硫酸中加入足量的铜粉反应放出二氧化硫气体少于10.08L |
查看答案和解析>>
科目: 来源: 题型:
| A、常温下可使某些金属钝化 |
| B、具有脱水性,故能作干燥剂 |
| C、加热条件下可与木炭反应,其氧化产物为CO2 |
| D、溶于水放出大量的热,稀释的时候应将浓硫酸缓缓加入水中并不断搅拌 |
查看答案和解析>>
科目: 来源: 题型:
| A、在常温下,浓硝酸不可储存在铝制容器中 |
| B、要从铝土矿中提取铝,必须获得较高纯度的氧化铝 |
| C、铝具有良好的抗腐蚀性,说明铝在空气中不易于氧气发生反应 |
| D、Al、Al2O3、AlCl3都既能和稀盐酸反应,又能和氢氧化钠溶液反应 |
查看答案和解析>>
科目: 来源: 题型:
| A、热稳定性:NaHCO3>Na2CO3 |
| B、相同浓度溶液的碱性:Na2CO3<NaHCO3 |
| C、都能与酸反应放出CO2,但剧烈程度:NaHCO3>Na2CO3 |
| D、Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3 |
查看答案和解析>>
科目: 来源: 题型:
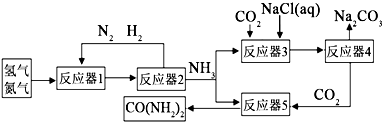
| ||
| 加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com