
科目: 来源: 题型:
| A、标准状况下,将5.6L的O2和5.6LNO的混合后的分子数约为0.5NA |
| B、2L 0.5mol/L BaCl2溶液中,阳离子所带电荷数为 NA |
| C、常温常压下,将0.2mol铝片投入含0.6molH2SO4的浓硫酸中,生成0.3 NA个SO2分子 |
| D、42g丙烯气体中,含有的σ键数目为8NA |
查看答案和解析>>
科目: 来源: 题型:
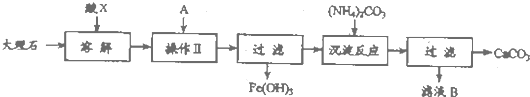
查看答案和解析>>
科目: 来源: 题型:
| A | B | C | D | |
| 试样 | Na2CO3(NaHCO3) | FeCl2(FeCl3) | Fe(A1) | Cl2(HCl) |
| 除杂试剂 | 澄清石灰水 | NaOH溶液 | NaOH溶液 | 饱和NaHCO3溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、测得其pH=7 |
| B、电解时得到H2与O2的体积比为2:1 |
| C、遇钠生成氢气 |
| D、1.01×105Pa时沸点为100℃ |
查看答案和解析>>
科目: 来源: 题型:
 碳及其化合物应用广泛.
碳及其化合物应用广泛.| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO)/mol | 0.200 | 0.160 | 0.125 | 0.099 | 0.080 | 0.080 |
| n(H2O)/mol | 0.300 | 0.260 | 0.225 | 0.199 | 0.180 | 0.180 |
| 1 |
| 2 |
| 3 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
| A、用过滤的方法除去食盐水中的泥沙 |
| B、用蒸馏的方法将自来水制成蒸馏水 |
| C、用酒精萃取碘水中的碘 |
| D、用加热的方法除去苏打中的小苏打 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com