
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
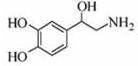
| A、每个去甲肾上腺素分子中含有3个酚羟基 |
| B、1mol去甲肾上腺素最多能与2molBr2 |
| C、甲肾上腺素分子不能与饱和的碳酸氢钠溶液发生反应 |
| D、去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:查看答案和解析>>
科目: 来源: 题型:
| A、用食醋除去暖水瓶中的水垢,水垢溶解,有无色气泡产生:2CH3COOH+CaCO3═Ca2++2CH3COO-+CO2↑+H2O |
| B、用稀硫酸除去铜绿:4H++Cu2(OH)2CO3=2Cu2++CO2↑+3H2O |
| C、向NaHCO3和CaCl2混合溶液中,加入少量NaOH溶液:OH-+HCO32-═CO32-+H2O |
| D、用小苏打治疗胃酸过多:HCO3-+H+═H2O+CO2↑ |
查看答案和解析>>
科目: 来源: 题型:
| 元素代号 | U | V | W | X | Y | Z | M |
| 原子半径/nm | 0.037 | 0.157 | 0.074 | 0.075 | 0.077 | 0.143 | 0.102 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 | +3 | -2,+6 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
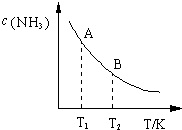 在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,
在一定条件下,N2(g)+3H2(g)?2NH3(g)△H=-93.0kJ?mol-1,| 时间/min 浓度/mol?L-1 | c (N2) | c (H2) | c (NH3) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com