
科目: 来源: 题型:

| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol?min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目: 来源: 题型:
| A、一定没有N2,CO和HCl中至少有一种 |
| B、一定没有N2,CO和HCl都有 |
| C、一定有N2,CO和HCl中至少有一种 |
| D、一定有N2和HCl,肯定没有CO |
查看答案和解析>>
科目: 来源: 题型:
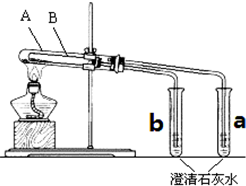 为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.
为探究碳酸钠和碳酸氢钠固体的热稳定性,某同学设计了“套管实验”,装置如图,大试管A与小试管a相连通,大试管B小试管b相连通.查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 有关问题 |
| ①计算所需NaCl的质量 | |
| ②称量NaCl固体 | 用托盘天平需要称量NaCl的质量. |
| ③将NaCl加入100mL烧杯中,并加入适量水 | 为了加快溶解速率,可以采取哪些措施: 用玻璃棒不断搅拌. |
| ④将烧杯中溶液转移至250mL容量瓶中 | 为了防止溶液溅出,应采取什么措施:用玻璃棒引流. |
| ⑤向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2厘米处应如何操作:改用胶头滴管加水至刻度线. |
查看答案和解析>>
科目: 来源: 题型:
| 时间/(min) | n(A)/( mol) | n(B)/( mol) | n(C)/( mol) |
| 0 | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
| 第8 min | 0.1 | 2.0 | 1.8 |
| 第9 min | 0.05 | 1.9 | 0.3 |
查看答案和解析>>
科目: 来源: 题型:
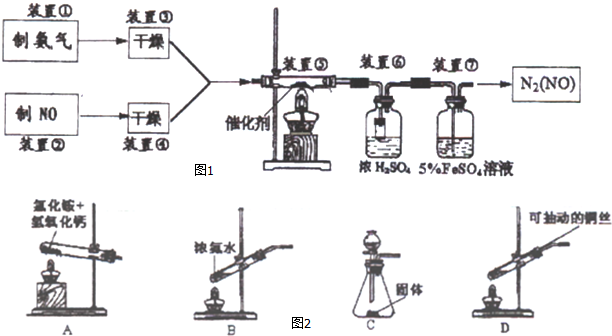
查看答案和解析>>
科目: 来源: 题型:
 实验室配制480mL 0.05mol/L的FeSO4溶液,实验操作步骤有:
实验室配制480mL 0.05mol/L的FeSO4溶液,实验操作步骤有:查看答案和解析>>
科目: 来源: 题型:
| A、H218O中投入Na2O2固体:2H218O+2Na2O2═4OH-+4Na++18O2↑ |
| B、Fe3O4与稀HNO3反应:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| C、向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目: 来源: 题型:
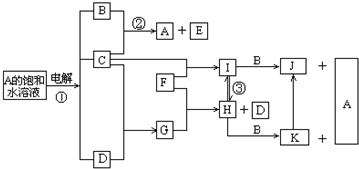
查看答案和解析>>
科目: 来源: 题型:
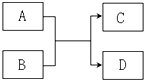 已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:
已知由短周期元素组成的物质 A、B、C、D,具有如图反应关系:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com