
科目: 来源: 题型:
| 1 |
| 11 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

| 序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
科目: 来源: 题型:
 Na、Cu、Al、O、C、H是常见的六种元素.
Na、Cu、Al、O、C、H是常见的六种元素.| 第一电离能 | 离子半径 | 沸点 |
| Na | O2- | CH4 |
| 物 质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
查看答案和解析>>
科目: 来源: 题型:
时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
查看答案和解析>>
科目: 来源: 题型:
| 容器 | 甲 | 乙 | 丙 |
| 相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
| 反应物投料 | 1mol N2、3mol H2 | 2mol NH3 | 2mol NH3 |
| 平衡时容器体积 | V甲 | V乙 | V丙 |
| 反应的平衡常数K | K甲 | K乙 | K丙 |
| 平衡时NH3的浓度/mol?L-1 | c甲 | c乙 | c丙 |
| 平衡时NH3的反应速率/mol?L-1?min-1 | v甲 | v乙 | v丙 |
| A、V甲>V丙 |
| B、K乙<K丙 |
| C、c乙>c甲 |
| D、v甲=v丙 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量a kJ |
| ② | 2 | 6 | 0 | 放出热量b kJ |
| ③ | 0 | 0 | 2 | 吸收热量c kJ |
| A、热量值关系一定满足:a=c<92.4 |
| B、三个容器内反应的平衡常数:③>①>② |
| C、达平衡时氨气的体积分数:①<② |
| D、N2的转化率:①>② |
查看答案和解析>>
科目: 来源: 题型:
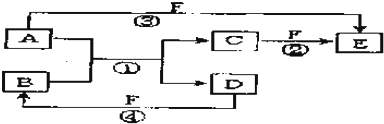
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com