
科目: 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目: 来源: 题型:
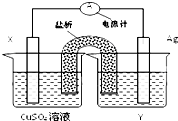 依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:
依据氧化还原反应2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、缩小体积使压强增大 |
| B、降低体系温度 |
| C、体积不变充入He使气体压强增大 |
| D、保持总压强不变,充入Ne气体 |
查看答案和解析>>
科目: 来源: 题型:
| A、金属元素的原子只有还原性,离子只有氧化性 |
| B、金属单质在常温下均是固体 |
| C、金属元素能存在于阳离子中,而不能存在于阴离子中 |
| D、金属元素在化合物中一定显正价 |
查看答案和解析>>
科目: 来源: 题型:
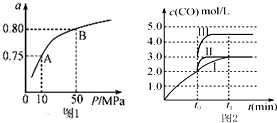 甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
甲醇是主要的化学工业基础原料和清洁液体燃料.工业上可以用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应及平衡常数 | 温度/℃ | ||
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g)△H1 | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?CO(g)+H2O(g)△H2 | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g)△H3 | K3 | ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 请回答下列问题:
请回答下列问题:| 温度/℃ | 800 | 1 000 | 1 200 | 1 400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1 771.5 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com