
科目: 来源: 题型:
| c(H+) | c(S
| c(Fe2+、Fe3+) | ||
| O | 2- 4 |
查看答案和解析>>
科目: 来源: 题型:
 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.| O | 2- 3 |
| O | 2- 3 |
查看答案和解析>>
科目: 来源: 题型:
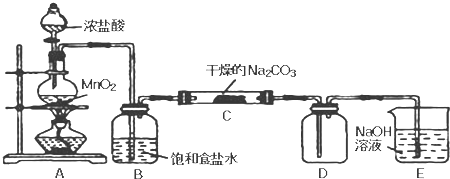
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中,加入蒸馏水至固体溶解,然后各取1~2mL所得溶液分别置于 甲、乙两支试管中. | 得到无色溶液 |
| 步骤2:向甲试管中加入过量的BaCl2溶液,静置. | 若溶液变浑浊,证明固体中含有 |
| 步骤3:取甲试管中上层清液少许于另一只试管中, 滴加少量 | 若 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中 | 若 证明固体中含有 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.
某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
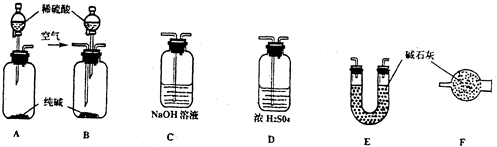
| 工业纯碱样品质量 | 反应前E的总质量 | 反应后E的总质量 |
| 5.5g | 43.9g | 46.1g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com