
科目: 来源: 题型:
| A、在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 |
| B、氢气可以在氯气中燃烧,说明燃烧反应未必需要氧气参与 |
| C、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸根本就不会反应 |
| D、反应CuSO4+H2S→CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于稀硫酸 |
查看答案和解析>>
科目: 来源: 题型:
A、2NaCl(s)+H2SO4(浓)
| ||||
B、C+2H2SO4(浓)
| ||||
C、Cu+2H2SO4(浓)
| ||||
D、2FeO+4H2SO4(浓)
|
查看答案和解析>>
科目: 来源: 题型:
| A、垃圾处理常用的方法是卫生填埋、堆肥和焚烧 |
| B、将垃圾分类并回收是处理的发展方向 |
| C、填埋垃圾不需要治理,只需深埋即可 |
| D、垃圾是污染物,不会产生二次污染 |
查看答案和解析>>
科目: 来源: 题型:

| A、2A(g)+B(g)═2C(g)△H=a(a<0) |
| B、2C(g)═2A(g)+B(g)△H=a(a<0) |
| C、2A+B═2C△H=a(a>0) |
| D、2C═2A+B△H=a(a<0) |
查看答案和解析>>
科目: 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目: 来源: 题型:
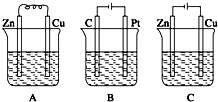 如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.
如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液.查看答案和解析>>
科目: 来源: 题型:
| 3 |
| 2 |
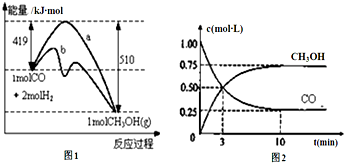
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com