
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目: 来源: 题型:
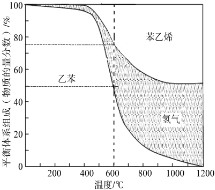 碳及其化合物是一类种类繁多的大家族.
碳及其化合物是一类种类繁多的大家族.查看答案和解析>>
科目: 来源: 题型:

| 三氯甲基苯基甲醇 | 式量:224.5.无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 式量:267.5.白色至微黄色晶体.熔点:88℃.不溶于水,溶于乙醇,70℃时在乙醇中溶解度为a g. |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |

| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将粗产品溶解在中,按粗产品、溶剂的质量比为1: | 得到无色溶液 | |
| ② | 将步骤1所得溶液 | ||
| ③ | 干燥步骤2所得白色晶体, | 白色晶体是结晶玫瑰 |
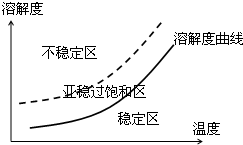
查看答案和解析>>
科目: 来源: 题型:
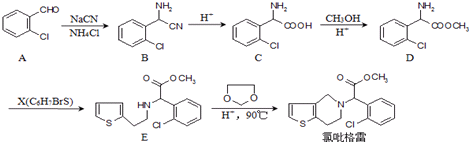
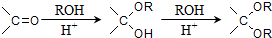
 的合成路线流程图(无机试剂任选).合成路线流程示意图为:
的合成路线流程图(无机试剂任选).合成路线流程示意图为: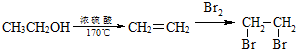
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com