
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的摩尔质量为: |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为: |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团: |
(4)A的核磁共振氢谱如下图: | (4)A中含有 |
| (5)综上所述,A的结构简式 | |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 | 固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 | KMnO4溶液紫色 不褪色 | 固体物质中不含 |
查看答案和解析>>
科目: 来源: 题型:
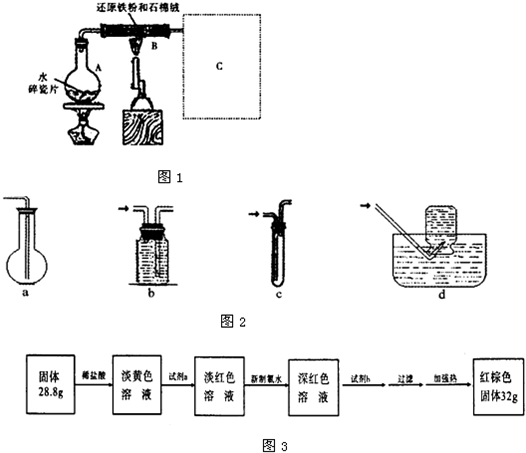
查看答案和解析>>
科目: 来源: 题型:
| 实验序号 | 实验操作 | 实验现象 |
| Ⅰ | 将一束光亮洁净的铁丝伸入AgNO3溶液中,一段时间后,过滤. | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
| Ⅱ | 取少量滤液,滴加几滴稀盐酸 | 有白色沉淀生成 |
| Ⅲ | 另取少量滤液,滴入K3[Fe(CN)6]溶液 | 有蓝色沉淀生成 |
| IV | 另取少量滤液,滴入KSCN溶液,振荡 | 溶液不变红,出现白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:
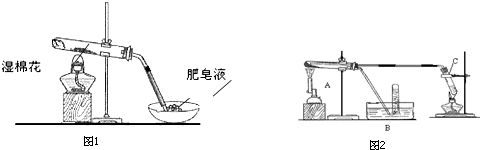
| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
查看答案和解析>>
科目: 来源: 题型:
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
查看答案和解析>>
科目: 来源: 题型:
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com