
科目: 来源: 题型:
 研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义.查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n (NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目: 来源: 题型:
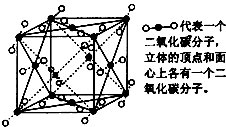 如图是干冰的晶胞结构示意图.请完成下列问题:
如图是干冰的晶胞结构示意图.请完成下列问题:查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
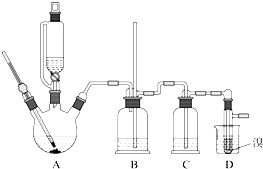 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 浓硫酸 |
| 170℃ |
| 加热 |
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目: 来源: 题型:
| A、该溶液一定呈酸性 |
| B、该溶液中的c(H+)肯定等于10-3mol/L |
| C、该溶液的pH可能为3,可能为11 |
| D、该溶液一定呈碱性 |
查看答案和解析>>
科目: 来源: 题型:
| 催化剂 |
| △ |

| A、由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B、点SO2、O2、SO3的平衡浓度之比为2:1:2 |
| C、达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
| D、压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目: 来源: 题型:
| A、使用催化剂和施加高压,都能提高反应速率,都对化学平衡状态无影响 |
| B、使用催化剂和施加高压,都能提高反应速率,只有压强对化学平衡状态有影响 |
| C、采用循环操作,能提高NH3的平衡浓度 |
| D、采用循环操作,能加快反应速率 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com