
科目: 来源: 题型:
 有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中的(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种.
有一种广泛用于汽车、家电产品上的高分子涂料,是按下列流程生产的.图中的(C3H4O)和A都可以发生银镜反应,N和M的分子中碳原子数相等,A的烃基上一氯取代位置有三种.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 滴定次数 | ( | ( | |||
| ( | ( | ( | 平均值 | ||
| 1 | 10.00 | ||||
| 2 | 10.00 | ||||
| 3 | 10.00 | ||||
查看答案和解析>>
科目: 来源: 题型:
| 盐酸 |
| 蒸馏 |
| 一定条件 |
| 用标准溶液滴定 |

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 起始n(M):n(H2O) | M转化率 | H2O转化率 |
| 1:1 | 0.5 | 0.5 |
| 1:2 | 0.67 | 0.33 |
| 1:3 | 0.75 | 0.25 |

查看答案和解析>>
科目: 来源: 题型:

| 实验过程 | 实验现象 | |
| Ⅰ | 通入一段时间N2加热 | A中固体变为红棕色,B中有白色沉淀生成,D试管中有无色液体生成 |
| Ⅱ | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| Ⅲ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| Ⅳ | 将重所得溶液滴入D试管中 | 混合溶液变为浅绿色 |
查看答案和解析>>
科目: 来源: 题型:
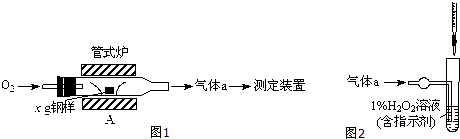
| ||
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 实验目的 | 实验方法 |
| 除去 NaHC03溶液中少量的 Na2C03 | |
| 检验自来水中是否含有Cl- | |
| 证明 Na2C03溶液呈碱性 | |
| 除去FeCl3溶液中少量的FeCl2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com