
科目: 来源: 题型:
| A、对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 |
| B、已知2C(s)+2O2(g)=2CO2(g)△H1,2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
| C、在一定条件下,某可逆反应的△H=+72.5kJ/mol,则该反应正反应活化能比逆反应活化能大72.5kJ/mol |
D、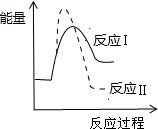 已知某物质在一定条件下可发生两个化学反应,反应过程中的总能量变化如图所示,由图示可知,反应Ⅰ是吸热反应,反应Ⅱ是放热反应,且反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2) |
查看答案和解析>>
科目: 来源: 题型:
| c(H+) |
| c(HCOOH) |
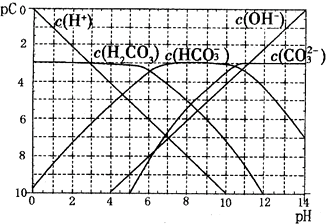
查看答案和解析>>
科目: 来源: 题型:
| A、将水沿着烧杯内壁注入浓硫酸中配制稀硫酸 |
| B、可用分液漏斗分离碘和四氯化碳 |
| C、将O2和H2的混合气体通过灼热的铜网以除去其中的O2 |
| D、将饱和的FeCl3溶液滴入沸水中加热至溶液呈红褐色即可制得Fe(OH)3胶体 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目: 来源: 题型:
| A、若为恒容容器,当a:b:c为2:2:1时,平衡不移动 |
| B、若在2min达平衡时,A物质的变化浓度为0.3mol/L,则用C表示该反应速率为0.3mol/(L?min) |
| C、若为恒压容器,当a:b为9:10,c为任意值时,平衡后A的质量分数一定仍为w% |
| D、若为恒压容器,当a=b=0,且c为任意值时,平衡后A的质量分数小于w% |
查看答案和解析>>
科目: 来源: 题型:

 的合成路线流程图(无极试剂任用),合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无极试剂任用),合成路线流程图示例如下:CH3CH2OH| 浓硫酸 |
| 170℃ |
| Br2 |

查看答案和解析>>
科目: 来源: 题型:
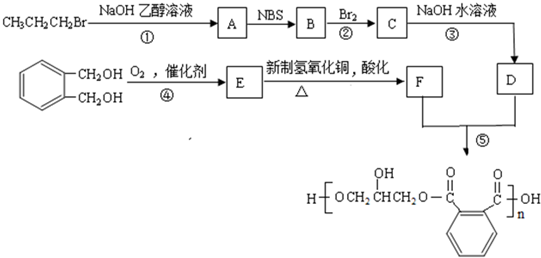
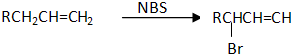
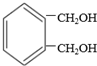 互为同分异构体的结构简式
互为同分异构体的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com