
科目: 来源: 题型:
| A、低温下能自发进行 |
| B、高温下能自发进行 |
| C、任何温度下都不能自发进行 |
| D、任何温度下都能自发进行 |
查看答案和解析>>
科目: 来源: 题型:
A、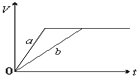 |
B、 |
C、 |
D、 |
查看答案和解析>>
科目: 来源: 题型:
| A、小苏打溶液中加入少量的澄清石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| B、磁性氧化铁在盐酸中长期浸泡:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| C、向Ca(ClO)2溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| D、向FeO中加入足量稀硝酸:FeO+2H+=2Fe2++H2O |
查看答案和解析>>
科目: 来源: 题型:
| A、足量氯气通入溴化亚铁溶液中:2Fe2++Cl2═2Cl-+2Fe3+ |
| B、三氯化铁溶液中滴入碘化钾溶液:Fe3++2I-═Fe2++I2 |
| C、氯化铜溶液中加入铁:Fe+Cu2+═Fe3++Cu |
| D、H2S通入FeCl3溶液中:H2S+2Fe3+═2Fe2++S↓+2H+ |
查看答案和解析>>
科目: 来源: 题型:
A、标准状况下,1L辛烷完全燃烧所生成的气体产物的分子数为
| ||
| B、1mol羟基(-OH)所含的电子总数为10NA | ||
| C、27g1,3-丁二烯分子中含有C=C双键数为NA | ||
| D、1mol碳正离子(CH3+)所含的电子总数为9NA |
查看答案和解析>>
科目: 来源: 题型:
| A、17gNH3所含质子数目为10NA | ||
| B、2.4g金属镁所含电子数目为0.2NA | ||
C、一个S原子的质量可表示为
| ||
| D、N=n?NA |
查看答案和解析>>
科目: 来源: 题型:
| A、反应2A(g)+B(g)=3C(s)+D(g)在一定条件下能自发进行,说明该反应的△H<0 |
| B、将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 |
| C、H2CO3分子不可能存在于pH=8的碱性溶液中 |
| D、在合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 |
查看答案和解析>>
科目: 来源: 题型:
| A、在常温常压下,11.2L氮气所含有的原子数为nA |
| B、活泼金属从盐酸中置换出1molH2,转移的电子数为nA |
| C、500mL0.5mol?L-1Al2(SO4)3溶液中,SO42-的浓度为1.5mol?L-1 |
| D、标准状况下,1.7g氨气中所含的电子数为10nA |
查看答案和解析>>
科目: 来源: 题型:

| A、0-3s内,容器中气体的压强不断增大 |
| B、达到平衡时放出0.6QkJ热量 |
| C、其他条件不变,升高温度,平衡常数减小 |
| D、其他条件不变,再向容器中充入1molPCl5(g),则达到平衡时,c(PCl5)>0.4mol?L-1 |
查看答案和解析>>
科目: 来源: 题型:
| 催化剂 |
| △ |
| 压强 SO2的转化率 温度 | 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa |
| 450℃ | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
| 550℃ | 85.6% | 92.9% | 94.9% | 97.7% | 98.3% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com