
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、硅酸凝胶干燥后可作实验室、袋装食品和瓶装药品的干燥剂 |
| B、硅可做半导体材料 |
| C、二氧化硅是现代光学及光纤制品的基本原料 |
| D、碳化硅是做电子组件的材料 |
查看答案和解析>>
科目: 来源: 题型:
| A、原混合物中氢氧化铁的质量分数可能为70% |
| B、所需0.5 mol?L-1 H2SO4 溶液的体积为600mL |
| C、原混合物中硫化亚铁的质量分数可能为25% |
| D、反应中转移电子物质的量为0.4mol |
查看答案和解析>>
科目: 来源: 题型:
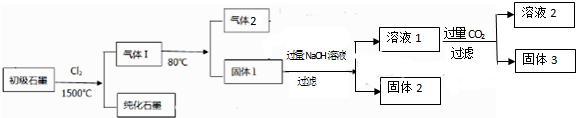
查看答案和解析>>
科目: 来源: 题型:
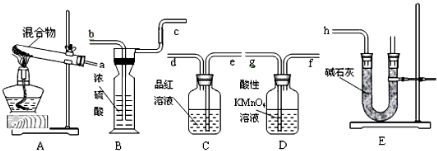
查看答案和解析>>
科目: 来源: 题型:
 (1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:
(1)Na2SO3和Na2S是硫元素的两种重要化合物,请回答下列问题:
| ||
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| ||
| ||

查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 实验现象 | 解释、结论 |
| ①取少量溶液于试管中,向其中滴加 | 溶液呈 | 说明此溶液阳离子是H+ |
| ②取少量溶液于另一个试管中,滴加 | 有不溶于稀硝酸的白色沉淀 | 说明此溶液的阴离子是,反应的化学方程式为 |
| 盐酸 |
| AgNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com