
科目: 来源: 题型:
| A、60s内反应速率为v(X)=0.05 mol/(L?s),X的转化率为80% | ||
| B、其它条件不变,若初始投入2mol X和2mol Y则物质Y的转化率减小 | ||
| C、其它条件不变,若升高温度,X的体积分数增大,则该反应的△H>0 | ||
D、其它条件不变,将容器体积变为4L,Z的平衡浓度变为原来的
|
查看答案和解析>>
科目: 来源: 题型:
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 碳酸氢铵与足量NaOH溶液混合反应:NH4++OH-=NH3?H2O | 错误,漏掉了HCO3-与OH-的离子反应 |
| B | 常温条件下,0.01mol?L-1的K2S溶液中:c(K+): c(S2-)>2 | 正确,部分S2-发生水解 |
| C | 足量硫酸铝溶液与碳酸氢钠溶液混合反应:Al3++3HCO3-═Al(OH)3↓+3CO2↑ | 正确,Al3+与HCO3-相互促进水解 |
| D | AlCl3溶液中加入过量氨水: Al3++3NH3?H2O═Al(OH)3↓+3NH4+ | 错误,产物应该是[Al(OH)4]- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、1.2mol?L-1?min-1 |
| B、1.0 mol?L-1?min-1 |
| C、0.5 mol?L-1?min-1 |
| D、0.4 mol?L-1?min-1 |
查看答案和解析>>
科目: 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 如图表示水溶液中c(H+)与c(OH-)的关系.
如图表示水溶液中c(H+)与c(OH-)的关系.
查看答案和解析>>
科目: 来源: 题型:
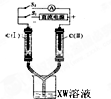 X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.
X、Y、M、Z、W为原子序数依次增大的五种短周期元素,其中X元素原子的核外电子总数等于其电子层数,Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水,X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水.查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com