
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.
原子序数小于36的X、Y、Z、W四种元素,原子序数依次增大.其中X元素的一种核素的质量数为12,中子数为6; Y是空气中含量最多的元素;Z的基态原子核外5 个轨道上填充了电子,且有2个未成对电子;W的原子序数为22.查看答案和解析>>
科目: 来源: 题型:
 (1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的最外层电子数是次外层电子数的2倍 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的非金属性强于Y的非金属性 |
| W | W的一种核素的质量数为63,中子数为34 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
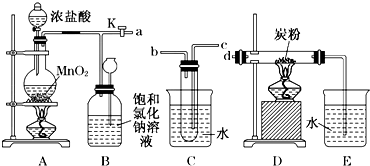

查看答案和解析>>
科目: 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com