
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

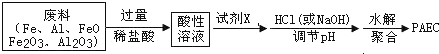
查看答案和解析>>
科目: 来源: 题型:
| 催化剂 |
| 加热加压 |
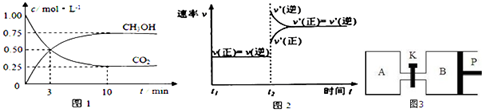
| 物质 | CH3OH | CH3OCH3 | H2O |
| c/mol L -1 | 0.9 | 0.60 | 0.60 |
查看答案和解析>>
科目: 来源: 题型:
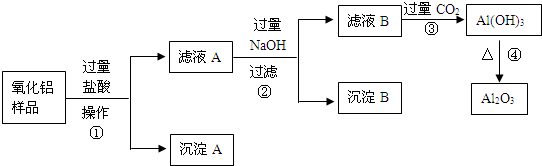
查看答案和解析>>
科目: 来源: 题型:
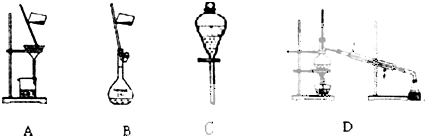
查看答案和解析>>
科目: 来源: 题型:
 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:查看答案和解析>>
科目: 来源: 题型:
| 测定时刻/s | t1 | t2 | t3 | t4 |
| C(A)/mol?L-1 | 6 | 3 | 2 | 2 |
| C(B)/mol?L-1 | 5 | 3.5 | 3 | 3 |
| C(C)/mol?L-1 | 1 | 2.5 | 3 | 3 |
| A、在容器中发生的反应为2A(g)+B(g)?2C(g) |
| B、该温度下,此反应的平衡常数为0.25 |
| C、A的转化率比B转化率的低 |
| D、在t3时刻反应已经停止 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、0.38mol |
| B、0.50mol |
| C、0.62mol |
| D、无法确定 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com