某矿样含有大量的CuS及少量其它不溶于酸的杂质.实验室中以该矿样为原料制备CuCl
2?2H
2O晶体,流程如下:
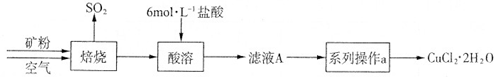
(1)在实验室中,欲用37%(密度为1.19g?mL
-1)的盐酸配制500mL 6mol?L
-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有
、
.
(2)①若在实验室中完成系列操作a.则下列实验操作中,不需要的是
(填下列各项中序号).

②CuCl
2溶液中存在如下平衡:Cu(H
2O)
42+(蓝色)+4Cl
-?CuCl
42-(黄色)+4H
2O.
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是
(填下列各项中序号). a.FeCl
3固体 b.CuCl
2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧CuS时,固体质量变化曲线及SO
2生成曲线如下图所示.

①CuS矿样在焙烧过程中,有Cu
2S、CuO?CuSO
4、CuSO
4、CuO生成,转化顺序为下列四阶段:
CuS
Cu
2S
CuO?CuSO
4CuSO
4CuO
第①步转化主要在200~300°C范围内进行,该步转化的化学方程式为
.
②300~400°C范围内,固体质量明显增加的原因是
,上图所示过程中,CuSO
4固体能稳定存在的阶段是
(填下列各项中序号).
a.一阶段 b、二阶段 c、三阶段 d、四阶段
③该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO
2和O
2的混合物.

a.装置组装完成后,应立即进行气密性检查,请写出检查A-D装置气密性的操作
.
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO
2和O
2的混合物.你认为装置D中原来盛有的溶液为
溶液.
c.若原CuS矿样的质量为l0.0g(含加热不反应的杂质),在实验过程中,保持温度在760°C左右持续加热,待矿样充分反应后,石英玻璃管内所得固体的质量为8.4g,则原矿样中CuS的质量分数为
.

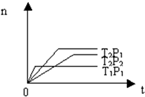 反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )
反应2X(g)+Y(g)?2Z(g);△H<0(正反应为放热反应),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示.则下列判断正确的是( )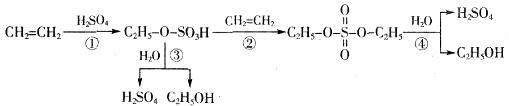

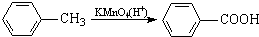


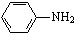 最多能够和
最多能够和 结构;
结构;