
科目: 来源: 题型:
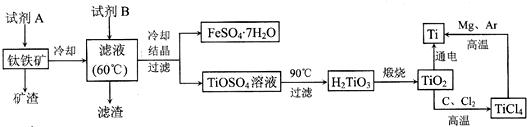
| ||
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
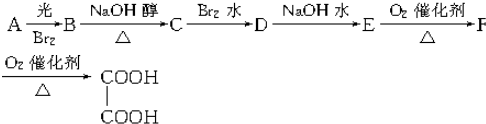
查看答案和解析>>
科目: 来源: 题型:
| A、方框中的物质应为Cu2S |
| B、该反应的部分产物可用于硫酸工业 |
| C、反应中SO2既是氧化产物又是还原产物 |
| D、反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
查看答案和解析>>
科目: 来源: 题型:
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
查看答案和解析>>
科目: 来源: 题型:

| A、平衡常数K(300℃)小于K(500℃) | ||
| B、在其他条件下不变时,压缩处于E点的体系体积,甲醇浓度增大 | ||
| C、300℃,当容器内气体密度不变时说明反应已经达到平衡 | ||
D、500℃,从反应开始到平衡,氨气的平均反应速率v(H2)=
|
查看答案和解析>>
科目: 来源: 题型:
| A、K2CO3 |
| B、BaCl2 |
| C、CH3COONa |
| D、Na2SO4 |
查看答案和解析>>
科目: 来源: 题型:
| A、氧化产物是HO2 |
| B、HO2在碱中能稳定存在 |
| C、氧化剂是O2 |
| D、1 mol Cu参加反应有2 mol电子发生转移 |
查看答案和解析>>
科目: 来源: 题型:
| ||
| A、①中MnO2和H2SO4都是氧化剂 |
| B、MnSO4的还原性小于Zn的还原性 |
| C、②中MnSO4发生氧化反应 |
| D、硫酸在该生产中可循环利用 |
查看答案和解析>>
科目: 来源: 题型:
| 实验序号 | 金属 状态 | c(H2SO4) /mol?L-1 | 溶液温度/℃ | 金属消失 的时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 丝 | 0.7 | 20 | 36 | 250 |
| 2 | 丝 | 0.8 | 20 | 35 | 200 |
| 3 | 粉末 | 0.8 | 20 | 35 | 25 |
| 4 | 丝 | 1.0 | ? | 35 | 125 |
| 5 | 丝 | 1.0 | 35 | 50 | 50 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com