
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、当加入HA至溶液pH=7时,溶液中的碱还未反应完 |
| B、在滴加HA的过程中,水的电离程度先减小后增加 |
| C、在滴加HA的过程中,溶液中可能存在如下浓度关系:c(A-)>c(Na+)>c(NH4+)>c(H+)>c(OH-) |
| D、反应到达终点时:c(NH4+)+c(NH3?H2O)=0.1mol?L-1 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
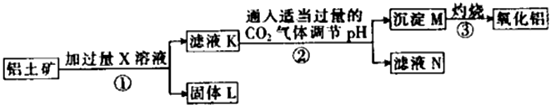
| A、X既可以是HCl,也可以是NaOH |
| B、第②步反应的离子方程式为2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
| C、固体L中含有Fe2O3和MgO等 |
| D、滤液N经蒸干、灼烧后可以得到纯净的Na2CO3固体 |
查看答案和解析>>
科目: 来源: 题型:
 学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案:
学校实验室现有含少量NaCl杂质的Na2CO3固体样品,某化学兴趣小组的同学决定测定样品Na2CO3的质量分数,甲、乙两位同学分别设计出下列两种实验方案:查看答案和解析>>
科目: 来源: 题型:
| D | ||
| A | B | C |
| E |
查看答案和解析>>
科目: 来源: 题型:
| A、H2O、O2 |
| B、CO2、H2 |
| C、CO2、H2O、O2 |
| D、CO2、CO |
查看答案和解析>>
科目: 来源: 题型:
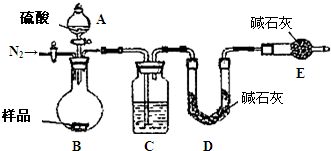 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列四种实验方案进行探究.请填空:| 加热 |
| 氯化钙溶液 |
| 硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com