
科目: 来源: 题型:
 今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:
今有常温条件下A、B、C三种溶液,A为0.01mol?L-1的HCl溶液,B为0.01mol?L-1的CH3COOH溶液,C为0.01mol?L-1的NaOH溶液,回答下列问题:查看答案和解析>>
科目: 来源: 题型:
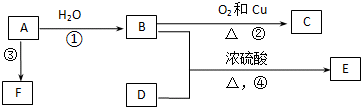
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

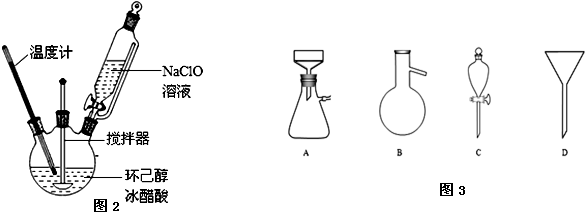
查看答案和解析>>
科目: 来源: 题型:
 含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.
含有弱酸HA和其钠盐NaA的混合溶液,在化学上用作缓冲溶液.向其中加入少量酸或碱时,溶液的酸碱性变化不大.查看答案和解析>>
科目: 来源: 题型:
 某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
某研究性小组拟用下述方案测定一份亚硫酸钠试样的氧化变质程度.
| 操作1 | 沉淀质量 | Na2SO3%计算表达式 | |
| 甲 | 先往溶液中加入足量盐酸,再滴入足量BaCl2 | b克 | (1-142b/233a)×100% |
| 乙 | 先往溶液中加入足量Ba(NO3)2,再滴入足量盐酸 | c克 | (1-142c/233a)×100% |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com