
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )
我校化学兴趣小组做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.则该条件下( )| A、生成的水分子化学性质比较活泼 |
| B、H2燃烧生成了具有氧化性的物质 |
| C、H2被冷却为液态氢,液氢的水溶液具有还原性 |
| D、H2燃烧的产物中可能含有一定量的H2O2 |
查看答案和解析>>
科目: 来源: 题型:

| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
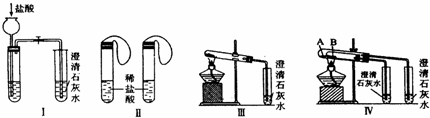
科目: 来源: 题型:

| A、实验一:验证二氧化碳密度大于空气,不支持燃烧 |
| B、实验二:探究燃烧需要的条件 |
| C、实验三:探究质量守恒定律 |
| D、实验四:测量空气中氧气所占的体积分数 |
查看答案和解析>>
科目: 来源: 题型:
| A、取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 |
| B、将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 |
| C、制取NaCl晶体时,将蒸发皿中NaCl溶液全部加热蒸干 |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,冷却至室温才能转移到容量瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com