
科目: 来源: 题型:
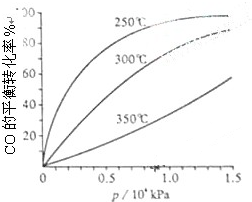 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目: 来源: 题型:
| A、同碳原子数的醇分子中羟基数目越多,该物质就越易溶于水 |
B、乳酸 ( )分子中含有手性碳原子 )分子中含有手性碳原子 |
| C、白磷分子和甲烷分子均为正四面体,键角为109°28′ |
| D、H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |
查看答案和解析>>
科目: 来源: 题型:

| 温度/℃ | 1000 | 1100 |
| 平衡常数 | 0.68 | 0.50 |
查看答案和解析>>
科目: 来源: 题型:
| c(B) |
| c(C) |
查看答案和解析>>
科目: 来源: 题型:
A、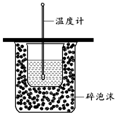 用如图装置测定中和热 |
| B、中和滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化 |
| C、研究H+浓度对该平衡:Cr2O72-+H2O?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 |
| D、测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
查看答案和解析>>
科目: 来源: 题型:
| A、5 s内以A表示的平均反应速率为0.15 mol?L-1?s-1 |
| B、n值等于4 |
| C、平衡时B的转化率为20% |
| D、平衡时,B的浓度为4mol?L-1 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )
向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1的CH3COOH溶液,其pH逐渐减小,图中a.b、c三点的pH为实验中所测得,下列有关说法中一定正确的是( )| A、.当7<pH<13时,溶液中c(Na)>c(CH3COO)>c(OH)>C(H) |
| B、.当pH=7时,所加CH3COOH溶液的体积为10 mL |
| C、当5<pH<7时,溶液中c(CH3COO)>c(Na) |
| D、.继续滴加0.1 mol?L-1的CH3COOH溶液,溶液的pH最终可以变化至1 |
查看答案和解析>>
科目: 来源: 题型:
| A、已知某温度下纯水中的c(H+)=2×l0-7mol/L,据此无法求出水中c(OH-) | ||||||||||
| B、已知MgCO3的KSP=6.82×l0-6,则在含有固体MgCO3的MgCl2、Na2CO3溶液中,都有:c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 mol2/L2 | ||||||||||
| C、常温下,Mg(OH)2能溶于氯化铵浓溶液的主要原因可能是NH4+结合OH-使沉淀溶解平衡发生移动 | ||||||||||
D、已知:
 (g)+3H2(g)→ (g)+3H2(g)→ (g) 的焓变 (g) 的焓变 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com