
科目: 来源: 题型:
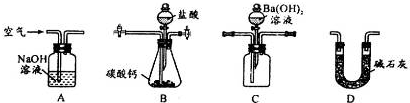
查看答案和解析>>
科目: 来源: 题型:
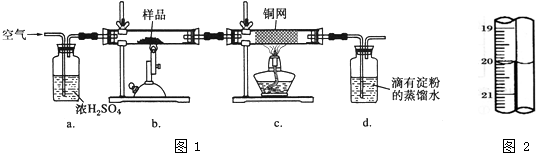
| 1 |
| 10 |
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
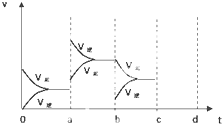 (1)如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是
(1)如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是查看答案和解析>>
科目: 来源: 题型:
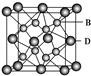 有A、B、C、D、E五种元素,其相关信息如下:
有A、B、C、D、E五种元素,其相关信息如下:| 元素 | 相关信息 |
| A | A原子的1s轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C基态原子的2p轨道中有3个未成对电子 |
| D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
| E | E的+1价离子的M能层中所有能级各轨道都有电子且没有未成对电子 |
查看答案和解析>>
科目: 来源: 题型:
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤 | 实验现象 |
| 甲同学:取少量(0.5~2mL)小烧杯中的溶液于洁净试管中,滴加1~2滴20%KSCN溶液 | ①若溶液显血红色,则假设 ②若溶液不发生颜色变化,则假设 |
乙同学: | ③若粉末 ④若粉末 ⑤若粉末 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com