
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
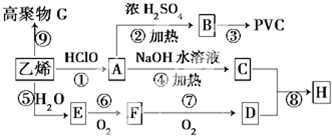
查看答案和解析>>
科目: 来源: 题型:
| A | B |
| C |
| A、B形成的单质存在同素异形体,C的单质不存在同素异形体 |
| B、C的最高价氧化物对应的水化物能与A的常见氢化物形成三种盐 |
| C、常温下,B的氢化物中无H+ |
| D、Y的种类比X多 |
查看答案和解析>>
科目: 来源: 题型:
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.查看答案和解析>>
科目: 来源: 题型:
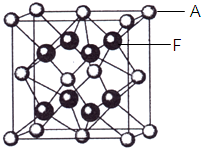
| 堆积模型 | 空间利用率 | 配位数 |
| bcp | 68% | 8 |
| hcp | 74% | 12 |
| ccp(fcc) | 74% | 12 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

| H2O/H+ |
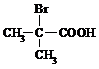 与足量NaOH溶液反应的化学方程式为
与足量NaOH溶液反应的化学方程式为查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com