
科目: 来源: 题型:
| ||
| ||
| ||
| A.浮选法富集方铅矿的过程属于化学变化 |
| B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO |
| C.整个冶炼过程中,制取1molPb共转移2mol电子 |
| D.将1molPbS冶炼成Pb理论上至少需要6g碳 |
查看答案和解析>>
科目: 来源: 题型:
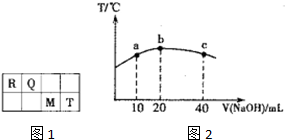 短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.
短周期元素R、Q、M、T在元素周期表中的相对位置如图1,已知R原子最外层电子数与次外层电子数之比为2:1.| +X |
| +X |
| 化合反应 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
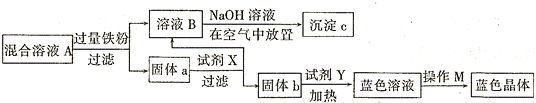
查看答案和解析>>
科目: 来源: 题型:
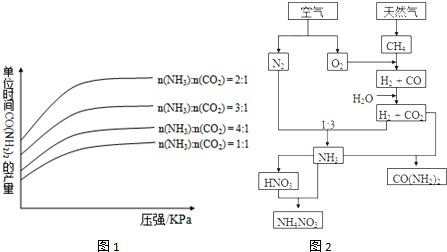
查看答案和解析>>
科目: 来源: 题型:
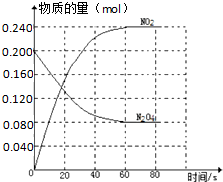 在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )
在容积固定为2.00L的密闭容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g)△H>0,100℃时体系中各物质的量(mol)随时间变化如图所示( )| A、100℃时,在0-60s时段反应的平均反应速率v(N2O4)=0.002mol/(L?s) |
| B、100℃时,反应的平衡常数K为0.72mol?L-1 |
| C、100℃时达到平衡后,其它条件不变,仅改变反应温度为T,N2O4以0.001mol/(L?s)的平均速率变化,经10s又达到平衡,则T大于100℃ |
| D、保持反应体系的温度不变(100℃),再向该平衡体系中再加入一定量的N2O4,重新达平衡后,N2O4的体积分数与原平衡相等 |
查看答案和解析>>
科目: 来源: 题型:
 菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.
菠菜营养丰富,“菠菜中富含可溶性草酸盐和碳酸盐”,长期以来民间流传着“菠菜不能与豆腐同食”的说法.某学校化学兴趣小组的同学拟通过实验探宄:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4?2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体,不溶于醋酸,能溶于强酸.| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量沉淀于试管中,加入 | |
| 步骤2: |
查看答案和解析>>
科目: 来源: 题型:
| A、4.3~9.7 |
| B、3.7~10.3 |
| C、4.0~10.0 |
| D、无法确定 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com