
科目: 来源: 题型:
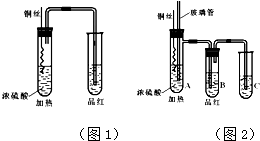 某学习小组利用教材中的装置(如图1)进行铜与浓硫酸的反应,实验中发现了3个问题:(ⅰ)没有尾气处理装置;(ⅱ)品红溶液产生倒吸;(ⅲ)试管内生成了白色固体,铜丝表面还有黑色固体.针对以上问题,学习小组进行了如下改进与探究.
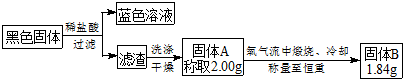
某学习小组利用教材中的装置(如图1)进行铜与浓硫酸的反应,实验中发现了3个问题:(ⅰ)没有尾气处理装置;(ⅱ)品红溶液产生倒吸;(ⅲ)试管内生成了白色固体,铜丝表面还有黑色固体.针对以上问题,学习小组进行了如下改进与探究.| 1 | 黑色固体可能含CuO、CuS、Cu2S以及被掩蔽的Cu2O |
| 2 | Cu2O在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为CuO |
| 3 | CuS和Cu2S常温下都不溶于稀盐酸,在氧气流中煅烧,CuS和Cu2S都转化为CuO和SO2 |
查看答案和解析>>
科目: 来源: 题型:
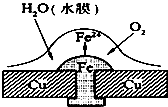
| A、此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| B、此过程中铜并不被腐蚀 |
| C、此过程中电子从Fe移向Cu |
| D、正极电极反应式为:2H++2e-=H2↑ |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、为使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
| B、用酒精灯给试管加热时,要将被加热的试管放在酒精灯火焰的外焰上 |
| C、为加速固体物质的溶解只能采用加热的方法 |
| D、为增大气体物质的溶解度,常采取搅拌、加热等措施 |
查看答案和解析>>
科目: 来源: 题型:
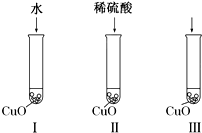 氧化铜是一种黑色固体,可溶于稀硫酸.某化学兴趣小组为探究稀硫酸中哪种粒子能使氧化铜溶解,该小组同学提出如下假设:
氧化铜是一种黑色固体,可溶于稀硫酸.某化学兴趣小组为探究稀硫酸中哪种粒子能使氧化铜溶解,该小组同学提出如下假设:查看答案和解析>>
科目: 来源: 题型:
| A、预制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| B、用碘的水溶液鉴别乙醇、四氯化碳 |
| C、欲配制质量分数为10%的CuSO4溶液,将10gCuSO4?5H2O溶解在90g水中 |
| D、某同学用托盘天平称量5.85gNaCl固体 |
查看答案和解析>>
科目: 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向溴乙烷中加入NaOH溶液,加热,充分反应后,加入AgNO3溶液 | 观察生成沉淀的颜色,以确定含有溴元素 |
| B | 向乙醛溶液中加入新制的银氨溶液,用酒精灯直接加热 | 确定乙醛中是否含有醛基 |
| C | 向苯和酒精的混合液中加入金属钠 | 确定苯中是否有酒精 |
| D | 纯净的乙炔气通入溴水溶液中,溴水褪色,且溶液pH前后变化不大 | 说明乙炔与Br2发生了加成反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:

| Al(OH)3 | Fe(OH)3 | |
| 开始沉淀的PH | 3.1 | 2.3 |
| 沉淀完全的 PH | 5.3 | 3.7 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
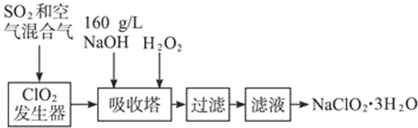
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com