
科目: 来源: 题型:
| A、a mol X+a mol Y |
| B、2a mol Z |
| C、a mol X+a mol Z |
| D、a mol Y+a mol Z |
查看答案和解析>>
科目: 来源: 题型:
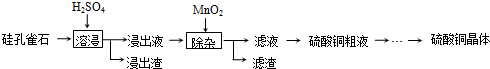
| 焙烧 |
| 还原 |
| 电解精炼 |
| ||

查看答案和解析>>
科目: 来源: 题型:

2- 3 |
2- 6 |
查看答案和解析>>
科目: 来源: 题型:
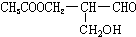 有光学活性,发生下列反应后生成的有机物仍有光学活性的( )
有光学活性,发生下列反应后生成的有机物仍有光学活性的( )| A、与甲酸发生酯化反应 |
| B、与NaOH水溶液共热 |
| C、与足量的氧气作用 |
| D、在催化剂存在下与氢气作用 |
查看答案和解析>>
科目: 来源: 题型:

| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:


| 3 | 0.4 |
| 3 | 4 |
| 离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 1.2 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
查看答案和解析>>
科目: 来源: 题型:
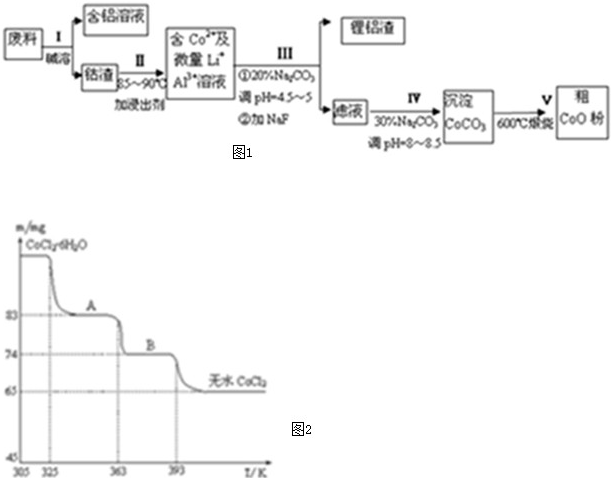
查看答案和解析>>
科目: 来源: 题型:
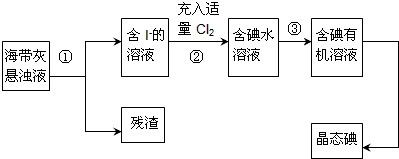
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com