
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
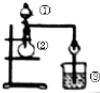
| 选项 | ① | ② | ③ | 实验结论 |
| A | 浓盐酸 | MnO2 | NaBr溶液 | 氧化性Cl2>Br2 |
| B | 浓氨水 | 碱石灰 | AgNO3溶液 | AgOH具有两性 |
| C | 浓硫酸 | Na2SO3 | FeCl3溶液 | SO2具有还原性 |
| D | 稀盐酸 | Na2CO3 | Na2SiO3 | 非金属性:Cl>Si |
查看答案和解析>>
科目: 来源: 题型:
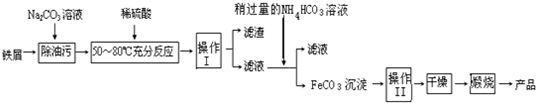
查看答案和解析>>
科目: 来源: 题型:
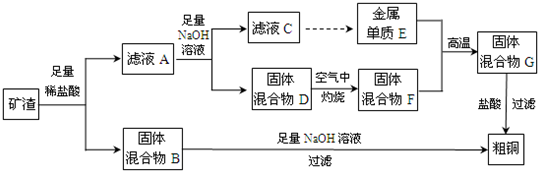
查看答案和解析>>
科目: 来源: 题型:

| 物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
| KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
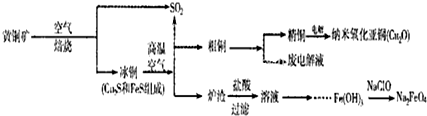
| ||
| ||
n(SO
| 91:9 | 1:1 | 1:91 | ||||
| PH(25℃) | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目: 来源: 题型:
| PH | 6.5~8.5 |
| Ca2+、Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |
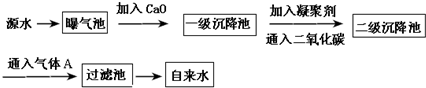
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com