
科目: 来源: 题型:
| A、BaCl2溶液 |
| B、稀盐酸 |
| C、KOH溶液 |
| D、NaNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:
| A、KCl溶液 |
| B、NaOH溶液 |
| C、稀H2SO4 |
| D、Na2SO4溶液 |
查看答案和解析>>
科目: 来源: 题型:
 实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目: 来源: 题型:
| A、读数时,俯视确定凹液面与刻度线相切 |
| B、容量瓶使用前经蒸馏水清洗后还残留有少量蒸馏水 |
| C、定容后把容量瓶颠倒摇匀,发现液面低于刻度线,又补足了所缺的水 |
| D、配制过程中,用蒸馏水洗涤烧杯和玻璃棒后,未把洗涤液移入容量瓶 |
查看答案和解析>>
科目: 来源: 题型:
| A、所用NaOH已经潮解 |
| B、向容量瓶中加水未到刻度线 |
| C、有少量NaOH溶液残留在烧杯里 |
| D、用带游码的托盘天平称2.4gNaOH时误用了“左码右物”方法 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 甲 | 乙 | |
| 丙 | 丁 |
查看答案和解析>>
科目: 来源: 题型:
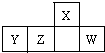 短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )
短周期元素X、Y、Z、W在周期表中的相对位置如图,W原子的最外层电子数是其最内层电子数的3倍.下列判断正确的是( )| A、原子半径:X>Y>Z>W |
| B、Y、Z是金属元素 |
| C、最简单气态氢化物的热稳定性:Z>W |
| D、X的氢化物能与其最高价氧化物对应的水化物反应生成盐 |
查看答案和解析>>
科目: 来源: 题型:
| 周 族 期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ |
查看答案和解析>>
科目: 来源: 题型:
 硼酸晶体具有层状结构,每一层的结构结构如图1所示.
硼酸晶体具有层状结构,每一层的结构结构如图1所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com