
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤和操作 | 实验现象 | 结论(-OH上氢原子活动性顺序) |
| (1)五种物质各取少量于五支试管中,各加入紫色石蕊试液2~3滴 | ②④变红,其它不变 | ②、④>①、③、⑤ |
| (2) | ||
| (3)①、③、⑤各取少量于试管中,各加入少量NaOH溶液 | ⑤由浑浊变澄清 | ⑤>①、③ |
| (4) |
查看答案和解析>>
科目: 来源: 题型:
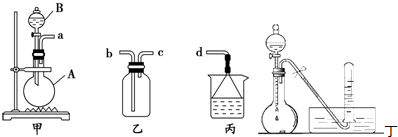
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

| Cl2 |
| 红磷(少量) |
 ,
, +RCl→
+RCl→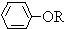 +NaCl
+NaCl查看答案和解析>>
科目: 来源: 题型:


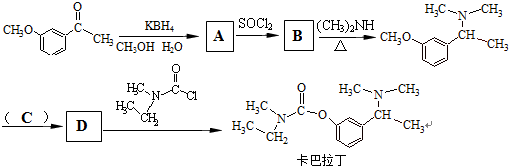
查看答案和解析>>
科目: 来源: 题型:


查看答案和解析>>
科目: 来源: 题型:
| 实验编号 | 烧杯中所加的试剂及其用量(mL) | 加入少 量固体 | 溶液褪色 时间(s) | |||
| 0.6mol/L H2C2O4溶液 | H2O | 0.2mol/L KMnO4溶液 | 3mol/L 稀硫酸 | |||
| 1 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| 2 | 15.0 | 15.0 | 10.0 | 无 | 3.6 | |
| 3 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| 4 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
| A、实验3、4说明K+对该反应有催化作用 |
| B、实验2中x=10 |
| C、实验1、2说明反应速率只与KMnO4浓度有关 |
| D、实验1、4可推出实验1中反应速率变化:起初较小,后明显变大,又逐渐变小 |
查看答案和解析>>
科目: 来源: 题型:
 NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.
NaHSO4可被过量KIO3氧化,当NaHSO3.完全消耗时即有I2析出.某课题组用淀粉作指示剂,通过测定溶液变蓝所用时间来探究影响化学反应速率的因素.| 实验编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 30 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目: 来源: 题型:
 实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.
实验小组利用酸性KMnO4溶液与H2C2O4溶液反应研究影响反应速率的因素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com