
科目: 来源: 题型:
| A、溶液中的c(CH3COO-) |
| B、溶液中的c(H+) |
| C、醋酸的电离平衡常数 |
| D、溶液中的c(OH-) |
查看答案和解析>>
科目: 来源: 题型:
| 0.01mol/L KIO3溶液的体积/mL | Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色所需的时间 | |
| 实验1 | 5 | 5 | V1 | 0 | a |
| 实验2 | 5 | 5 | 40 | 25 | b |
| 实验3 | 5 | V2 | 35 | 25 | c |
查看答案和解析>>
科目: 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积(mL) | 50 | 120 | 224 | 392 | 472 | 502 |
查看答案和解析>>
科目: 来源: 题型:
| 电离常数(25℃) |
| HF: Ka1=3.6×10-4 |
| H3PO4: Ka1=7.5×10-3 Ka2=6.2×10-8 Ka3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-→H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:PO43->F->HPO42- |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
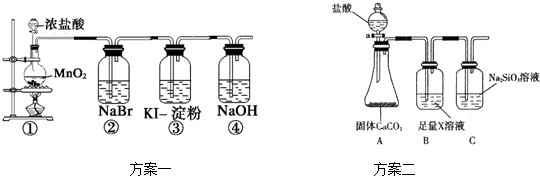

查看答案和解析>>
科目: 来源: 题型:
| H2SO4 |
| △ |
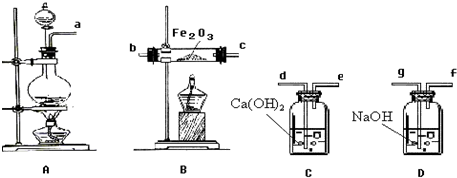
查看答案和解析>>
科目: 来源: 题型:

| A、装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |
查看答案和解析>>
科目: 来源: 题型:

| A、A气体是CO2,B气体是NH3 |
| B、第Ⅲ步得到的晶体是Na2CO3?10H2O |
| C、第Ⅱ步的离子方程式为Na++NH3?H2O+CO2═NaHCO3↓+NH4+ |
| D、第Ⅳ步操作的主要过程有溶解、蒸发、结晶 |
查看答案和解析>>
科目: 来源: 题型:
| 化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 | 1.75×10-5 | 3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 |
| A、等物质的量浓度的各溶液pH关系为:pH(NaClO)>pH(Na2CO3)>pH(NaHCO3)>pH(CH3COONa) |
| B、向NaClO溶液中通入少量CO2气体反应为:ClO-+H2O+CO2=HClO+HCO3- |
| C、等物质的量浓度的HClO稀溶液与NaOH稀溶液等体积混合后溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+) |
| D、Na2CO3和NaHCO3混合液中,一定有:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com