
科目: 来源: 题型:
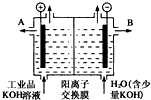 铝和氢氧化钾都是重要的工业产品.请回答:
铝和氢氧化钾都是重要的工业产品.请回答:查看答案和解析>>
科目: 来源: 题型:

| A、原子半径的大小为A>B>C>D |
| B、D的氢化物在同族元素的氢化物中沸点最低 |
| C、生成氢化物的稳定性为A>B>C>D |
| D、A、B、C、D的单质常温下均不导电 |
查看答案和解析>>
科目: 来源: 题型:
| A、铜在冷的浓硫酸中会钝化,所以把铜放入冷的浓硫酸中无明显现象 |
| B、NaOH溶液和AlCl3溶液相互滴加的现象不同 |
| C、金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 |
| D、Al与热水反应困难,故活泼性不及Al的金属在任何条件下均不能与H2O发生反应 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
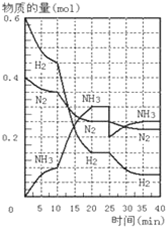 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N2?2NH3△H<0.反应过程中H2、N2和NH3物质的量变化如图所示,据图判断下列叙述不正确的是( )| A、反应开始到第一次平衡时,N2的平均反应速率为0.0625mol?(L?min)-1,H2的转化率为75% |
| B、反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[c3(H2)?c(N2)]=(0.15 mol?L-1)2/[(0.075 mol?L-1)3?(0.125 mol?L-1)] |
| C、从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂 |
| D、从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com