
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、在所有元素中,氟的电离能最大 |
| B、铝的第一电离能比镁的第一电离能大 |
| C、第3周期所含的元素中钠的第一电离能最小 |
| D、钾的第一电离能比镁的第一电离能大 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
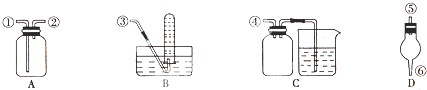
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、将2.5 g CuSO4?5H2O溶解在97.5 g水中配制质量分数为2.5%的CuSO4溶液 |
| B、配制1 mol/L NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 |
| C、将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL配制100 mL 1.0 mol/L Na2SO4 |
| D、配制900 mL 2 mol/L的NaCl溶液时,选用900 mL容量瓶和称取105.3 g NaCl |
查看答案和解析>>
科目: 来源: 题型:
 硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):
硫铁矿又称黄铁矿,是生产硫酸的原料,其主要成分为FeS2.850℃~950℃时,硫铁矿在空气中煅烧,可能发生下列反应(设空气中N2与O2体积比为4:1):查看答案和解析>>
科目: 来源: 题型:
| A、所有元素中原子半径最小的是F |
B、根据π键的成键特征判断C-C的键能与  键能的关系是双键的键能小于单键的键能的2倍 键能的关系是双键的键能小于单键的键能的2倍 |
| C、元素电负性越小,元素非金属性越强 |
| D、第n周期第n主族的元素均为金属 |
查看答案和解析>>
科目: 来源: 题型:
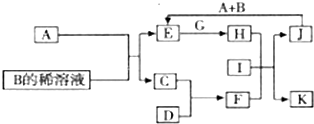 A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.
A-L为中学化学常见物质,其主要转化关系如下图所示(其中产物水已略去).已知A为金属单质,C、D通常状况下为气体单质.B、F均为重要的化工产品,0.05mol/LB的溶液pH=1,F具有刺激性气味的气体,将一定量F通入B的稀溶液中可以得到两种盐K和L.G和I分别由相同的两种元素组成,通常状况下均为无色液体.查看答案和解析>>
科目: 来源: 题型:
 某同学欲配制100mL 0.10mol/L CuSO4溶液.以下操作1~5是其配制过程及示意图:
某同学欲配制100mL 0.10mol/L CuSO4溶液.以下操作1~5是其配制过程及示意图:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com