
科目: 来源: 题型:
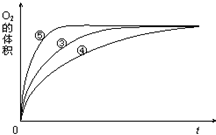 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
查看答案和解析>>
科目: 来源: 题型:
| 编号 | 往烧杯中加入的试剂及其用量(mL) | 催化剂 | 溶液开始变蓝时间(min) | ||||
| 0.1 mol?L-1 KI溶液 | H2O | 0.01mol?L-1 X 溶液 | 0.1 mol?L-1 双氧水 | 1 mol?L-1 稀盐酸 | |||
| 1 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 无 | 1.4 |
| 2 | 20.0 | m | 10.0 | 10.0 | n | 无 | 2.8 |
| 3 | 10.0 | 20.0 | 10.0 | 20.0 | 20.0 | 无 | 2.8 |
| 4 | 20.0 | 10.0 | 10.0 | 20.0 | 20.0 | 5滴Fe2(SO4)3 | 0.6 |
查看答案和解析>>
科目: 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目: 来源: 题型:
 某同学为了检验家中的一瓶补铁药(成分为FeS04)是否变质,设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,再进行如下图所示操作.
某同学为了检验家中的一瓶补铁药(成分为FeS04)是否变质,设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,再进行如下图所示操作. | 现象 | 结论 |
| ①中酸性KMnO4溶液褪色 ②中KSCN溶液不变色 | |
| ①中酸性KMnO4溶液不褪色 ②中KSCN溶液变红 | |
| ①中酸性KMnO4溶液褪色 ②中KSCN溶液变红 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、探究SO2和Na2O2反应可能有Na2SO4生成 |
| B、探究NO和N2O可能化合生成NO2 |
| C、探究NO2可能被NaOH溶液完全吸收生成NaNO2、NaNO3和H2O |
| D、探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用 |
查看答案和解析>>
科目: 来源: 题型:
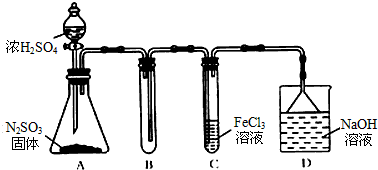
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com