
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| 微粒 | EO2- | EO3- |
| 立体构型名称 |

查看答案和解析>>
科目: 来源: 题型:
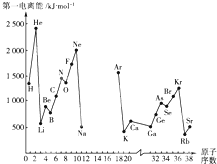 根据信息回答列问题:
根据信息回答列问题:| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目: 来源: 题型:
| 金属 | 电子流动方向 | 电压/V |
| Fe | Fe→Cu | +0.78 |
| Zn | Zn→Cu | +1.10 |
| A | Cu→A | +0.15 |
| B | B→Cu | +0.3 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B、棕红色Br2蒸气加压后颜色变深 |
| C、SO2催化氧化成SO3的反应,往往需要使用催化剂 |
| D、H2、I2、HI平衡混和气加压后颜色变深 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com