
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 实验步骤(不要求写具体操作过程) | 预期现象和结论 |
| ① ② … | 若银镜消失,假设2成立. 若银镜不消失,假设2不成立. |
查看答案和解析>>
科目: 来源: 题型:
 TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业.工业上利用TiO2制备金属钛的流程如下.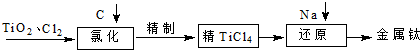
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
查看答案和解析>>
科目: 来源: 题型:
| 实验方案 | 实验现象与结论 |
| 取少量干燥的蓝绿色固体于试管中, |

查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:

| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Ca2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | 9.6 | 4.2 | 9.7 | - |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8.0 | 11.7 | 9.0(>9.0溶解) |
查看答案和解析>>
科目: 来源: 题型:
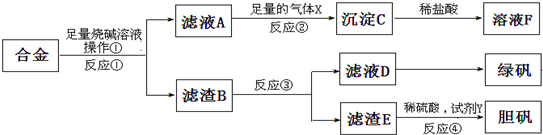
查看答案和解析>>
科目: 来源: 题型:
| A、某无色溶液滴加氯水和CCl4,振荡、静置分层后,下层溶液显紫色,则原溶液中有I- |
| B、取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- |
| D、某无色溶液用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液含有Na+无K+ |
查看答案和解析>>
科目: 来源: 题型:
 如图是一套检验气体性质的实验装置示意图.如图所示,向装置中缓慢通入气体X,若关闭活塞K,则试管中的品红试液无变化,而烧杯中的石灰水变浑浊;若打开活塞K,则品红试液褪色.根据此现象判断,气体X和洗气瓶内液体Y可能是( )
如图是一套检验气体性质的实验装置示意图.如图所示,向装置中缓慢通入气体X,若关闭活塞K,则试管中的品红试液无变化,而烧杯中的石灰水变浑浊;若打开活塞K,则品红试液褪色.根据此现象判断,气体X和洗气瓶内液体Y可能是( )| A、③和④ | B、②和④ |
| C、①和② | D、②和③ |
查看答案和解析>>
科目: 来源: 题型:

| A、将水准管上提,液面高于量气管且不下降,说明装置不漏气 |
| B、若已知参加反应的Zn的质量,则该装置可用来测定气体摩尔体积 |
| C、若已知参加反应的Zn的质量,则该装置可用来测定锌的相对原子质量 |
| D、反应停止后,立即读数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com