
科目: 来源: 题型:
 生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.
生理盐水,是指生理学实验或临床上常用的渗透压与动物或人体血浆的渗透压相等的氯化钠溶液.浓度:用于两栖类动物时是0.67~0.70%,用于哺乳类动物和人体时是0.85~0.9%人们平常点滴用的氯化钠注射液浓度是0.9%,可以当成生理盐水来使用.请回答下面有关点滴用的氯化钠注射液的问题.查看答案和解析>>
科目: 来源: 题型:
 工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题:
工业上以黄铁矿为原料,采用接触法生产硫酸.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.
某河道两旁有甲、乙两个化工厂.它们排放的澄清工业废水中,共含有Na+、Ag+、Fe3+、C1-、OH-、NO3-六种离子.查看答案和解析>>
科目: 来源: 题型:
 纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.
纳米碳酸钙广泛应用于橡胶、塑料、造纸、化学建材、油墨、涂料、密封胶与胶粘剂等行业.在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙.某校学生实验小组设计如图1所示装置,制取该产品.D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去.查看答案和解析>>
科目: 来源: 题型:
| 试管 | 未加MnSO4的试管 | 加有MnSO4的试管 |
| 褪色时间 | 30s | 2s |
| 试管 | 未滴加稀硫酸的试管 | 滴加了稀硫酸的试管 |
| 褪色时间 | 100s | 90s |
| 试管 | 滴入10滴稀硫酸的试管 | 加入1mL稀硫酸的试管 | 加入2mL稀硫酸的试管 |
| 褪色时间 | 70s | 100s | 120s |
| Mn2+ |
| Mn2+ |
| Mn2+ |
| C2O42- |
查看答案和解析>>
科目: 来源: 题型:
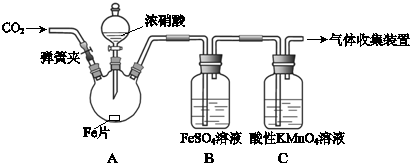
| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹. | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞. | 无明显现象. |
| 加热烧瓶,反应开始后停止加热. | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅.②反应停止后,A中无固体剩余. |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、反应物分子必须碰撞才有可能发生反应 |
| B、发生有效碰撞的分子具有最高的能量 |
| C、有效碰撞是活化分子在一定方向上的碰撞 |
| D、活化分子的平均能量称之活化能 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com