
科目: 来源: 题型:


| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g?L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目: 来源: 题型:
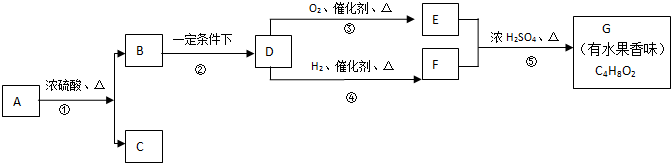
| 一定条件下 |
查看答案和解析>>
科目: 来源: 题型:


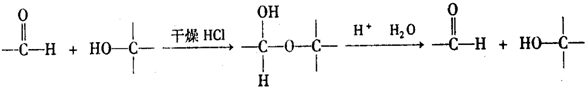

查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
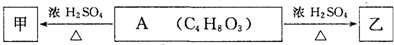
| HCl |
| △ |
| HCl |
| △ |
| NH3 |
| △ |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、2H+(aq)+SO42- (aq)+Ba2+(aq)+2OH-(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ?mol-1 | ||
| B、2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l)△H=-57.3 kJ?mol-1 | ||
C、C8H18(1)+
| ||
D、C8H18(g)+
|
查看答案和解析>>
科目: 来源: 题型:
| A、哈伯法合成氨是吸热反应,新法合成氨是放热反应 |
| B、新法合成氨不需要在高温条件下,可节约大量能源,具有发展前景 |
| C、新法合成氨能在常温下进行是因为不需要断裂化学键 |
| D、新催化剂降低了反应所需要的能量,使平衡正向移动 |
查看答案和解析>>
科目: 来源: 题型:
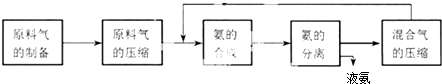
| A、混合气进行循环利用遵循绿色化学思想 |
| B、对原料气进行压缩可以增大原料气的转化率 |
| C、合成氨反应须在低温下进行 |
| D、使用催化剂可以提高反应的速率,但是不能使平衡向正反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| A、等于0.3mol |
| B、等于0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com