
科目: 来源: 题型:
 (1)设计的原电池如图1所示,回答下列问题:
(1)设计的原电池如图1所示,回答下列问题:查看答案和解析>>
科目: 来源: 题型:
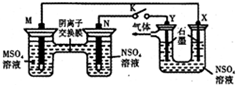 在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )
在下列装置中,MSO4和NSO4是两种生活中常见金属的易溶盐.当K闭合时,SO42-从右到左通过交换膜移向M极,下列分析正确的是( )| A、左装置中溶液c(M2+)减小 |
| B、N和X的电极反应式均为:N2++2e-=N |
| C、Y电极上有O2产生,发生还原反应 |
| D、若M电极转移了0.4mol电子,则y电极生成2.24L气体 |
查看答案和解析>>
科目: 来源: 题型:
| A、N2在阴极上被氧化 | ||||
| B、可选用铁作为阳极材料 | ||||
| C、阳极的电极反应式是N2+6H++6e-═2NH3 | ||||
D、该过程的总反应式是N2+3H2
|
查看答案和解析>>
科目: 来源: 题型:
| A、此法的优点之一是原料来源丰富 |
| B、进行①②③步骤的目的是从海水中提取氯化镁 |
| C、第④步电解制镁是由于镁是很活泼的金属 |
| D、以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目: 来源: 题型:
 如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液.(该过程中不考虑两球浮力的变化)下列说法正确的是( )
如图所示,杠杆A、B两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,小心地向水槽中滴入CuSO4 浓溶液.(该过程中不考虑两球浮力的变化)下列说法正确的是( )| A、若杠杆由绝缘体材料制成,一段时间后,杠杆一定B端高A端低 |
| B、若杠杆由导体材料制成,一段时间后,杠杆一定B端高A端低 |
| C、若杠杆由导体材料制成,一段时间后,杠杆一定A端高B端低 |
| D、无论杠杆由绝缘体材料还是由导体材料制成,一段时间后,杠杆一定A端高B端低 |
查看答案和解析>>
科目: 来源: 题型:
| A、电池的电解质溶液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池放电过程中,溶液中的OH-向负极移动 |
| D、电池放电与充电过程发生的化学反应是可逆反应 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
| A、若反应中转移的电子为nmol,则0.15<n<0.25 |
| B、n(Na+):n(Cl-)可能为7:3 |
| C、与NaOH反应的氯气一定为0.3mol |
| D、n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com