
科目: 来源: 题型:

| 实验记录 | 实验分析或实验结论 | |
| 现象 | 硬质玻璃管内物质由绿色变为红棕色 | 说明生成的物质有 |
| 干燥管内物质颜色由白色变为 | 说明生成的物质有 | |
数据 | 称取绿矾样品质量11.12g | |
| C装置增重1.28g | 说明生成SO2 | |
| A装置中生成白色沉淀4.66g | 说明生成SO3 |
查看答案和解析>>
科目: 来源: 题型:
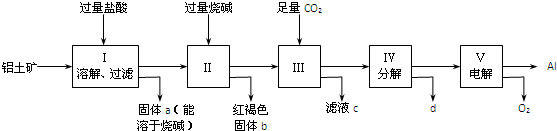

查看答案和解析>>
科目: 来源: 题型:
| 实验 | 酸或碱 | 现象 |
| A | 1滴0.2mol/LNaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1mol/L硫酸溶液 | 迅速变棕褐色 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
 据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.
据报道双氧水接触银能剧烈反应,为消除用硝酸清洗试管内壁上的银时产生的有毒气体污染环境,体现“绿色化学”的理念,某学校活动小组利用该反应清洗试管内壁上的银,并进一步研究反应的机理.他们查阅资料(资料信息:硝酸氧化性比过氧化氢强,能氧化过氧化氢;碘化银为黄色固体;稀硝酸与银单质反应条件为加热),设计并完成了以下实验.查看答案和解析>>
科目: 来源: 题型:
2- 4 |
| O | 2- 4 |
| O | 2- 4 |

| O | 2- 4 |
查看答案和解析>>
科目: 来源: 题型:
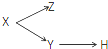
| X | Y | Z | H | |
| A | 分散系 | 胶体 | 溶液 | 烟 |
| B | 电解质 | 酸 | 碱 | 盐 |
| C | 元素周期表的纵列 | 主族 | 副族 | 卤族 |
| D | 化合物 | 共价化合物 | 离子化合物 | 酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com