
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.
现在七种元素,其中A、B、C、D、E为短周期元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答下列问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B原子L层有2个未成对电子 |
| C元素原子的核外p电子数比s电子数少1 |
| D元素最外层电子数是电子层数的3倍 |
| E原子的第一到第四电离能分别是:I1=738kJ/mol、I2=1451kJ/mol、I3=7733kJ/mol、I4=10540kJ/mol |
| F是前四周期中电负性最小的元素 |
| G原子核外M层全充满,N层只有1个电子 |
 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了查看答案和解析>>
科目: 来源: 题型:
| CuO |
| 加热 |
查看答案和解析>>
科目: 来源: 题型:
| 元素 | 部分结构知识 | 部分性质 |
| X | X原子核外电子占有9个原子轨道 | X的一种氧化物是形成酸雨的主要物质 |
| Y | Y原子的次外层电子数等于最外层电子数的一半 | Y能形成多种气态氢化物 |
| Z | Z原子的最外层电子数等于2n-3 (n为原子核外电子层数) | 化学反应中Z原子易失去最外层电子形成Zn+ |
| W | W基态原子的外围电子排布式为3d64s2 | 高温下,W与水蒸气反应生成氢气和黑色氧化物 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| M | M的一种核素的质量数为63,中子数为34 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
| A、溶液中无法确定Al3+的存在与否 |
| B、原溶液中不含的离子为:K+、Al3+、CO32- |
| C、步骤②中可以确定Fe2+、NO3-的存在 |
| D、步骤③中共有2种钡盐沉淀 |
查看答案和解析>>
科目: 来源: 题型:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
查看答案和解析>>
科目: 来源: 题型:
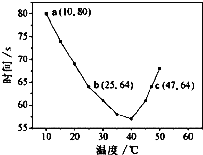 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B、温度高于40℃时,淀粉不宜用作该实验的指示剂 |
| C、图中a点对应的NaHSO3平均反应速率为2.5×10-4mol?L-1?s-1 |
| D、图中b、c两点对应的NaHSO3反应速率:b<c |
查看答案和解析>>
科目: 来源: 题型:
| 2 |
| 3 |
| A、22.2% |
| B、28.2% |
| C、33.3% |
| D、37.8% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com