
科目: 来源: 题型:
 利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )
利用下列各组物质制备和收集少量相应气体,能采用如图实验装置的是( )| A、①②⑥ | B、②④ |
| C、①②③⑥ | D、全部 |
查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、AgX | B、AgY |
| C、AgZ | D、无法确定 |
查看答案和解析>>
科目: 来源: 题型:
| A、溶度积就是溶解平衡时难溶电解质在溶液中的各离子浓度的乘积 |
| B、溶度积常数是不受任何条件影响的常数,简称溶度积 |
| C、可用离子积Qc判断沉淀溶解平衡进行的方向 |
| D、所有物质的溶度积都是随温度的升高而增大的 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
科目: 来源: 题型:
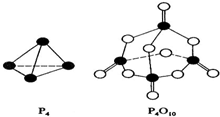
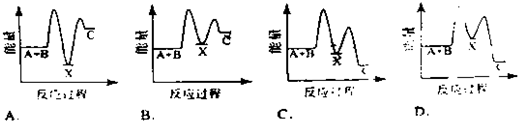
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com