
科目: 来源: 题型:
 火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.
火力发电厂释放出的大量氧化物(NOx)、SO2、CO2会对环境造成污染.对这些废气进行脱硝、脱碳和脱硫处理,可达到节能减排、废物利用等目的.查看答案和解析>>
科目: 来源: 题型:

| A、碳原子中的质子数为6 |
| B、碳的相对原子质量是12.01g |
| C、碳属于金属元素 |
| D、碳的氧化物只有一种 |
查看答案和解析>>
科目: 来源: 题型:
 完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:
完成下列热化学方程式(化学方程式、电极反应式、表达式等)的书写:查看答案和解析>>
科目: 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目: 来源: 题型:
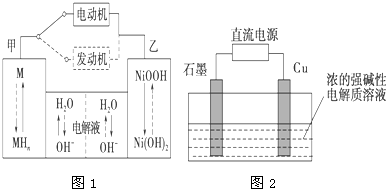 运用相关原理,回答下列问题:
运用相关原理,回答下列问题:| 1 |
| 2 |
| 3 |
| 2 |
| 放电 |
| 充电 |
| ||
查看答案和解析>>
科目: 来源: 题型:
| A、温度一定时,当溶液中c(Ag+)×c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液 |
| B、AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-) |
| C、向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| D、将固体AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,AgCl溶解度小于AgI |
查看答案和解析>>
科目: 来源: 题型:
| A、降低温度 |
| B、增大压强 |
| C、增大CO的浓度 |
| D、使用催化剂 |
查看答案和解析>>
科目: 来源: 题型:
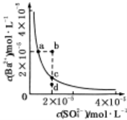 某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )
某温度时,BaSO4在水中的沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq)Ksp=c(Ba2+)?c(SO42-),沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A、b点时c(Ba2+)?c(SO42- )小于Ksp |
| B、a点对应的Ksp等于c点对应的Ksp |
| C、加水稀释可以使溶液由b点变到c点 |
| D、加入适量的Na2SO4不可能使溶液由a点变到c点 |
查看答案和解析>>
科目: 来源: 题型:
 某兴趣小组同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质.请回答下列问题:
某兴趣小组同学共同设置了如图所示的实验装置,即可用于制取气体,又可用于验证物质的性质.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com