
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
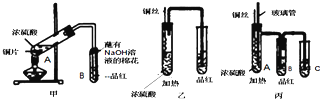
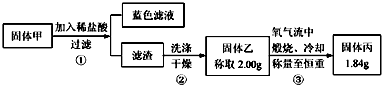
查看答案和解析>>
科目: 来源: 题型:
| A、甲溶液含有Ba2+ |
| B、乙溶液不含SO42- |
| C、丙溶液不含Cl- |
| D、丁溶液含有Mg2+ |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
| A、△H3=△H1+2△H2 |
| B、△H3=△H1+△H2 |
| C、△H3=△H1-2△H2 |
| D、△H3=△H1-△H2 |
查看答案和解析>>
科目: 来源: 题型:
| 催化剂 |
| △ |
| A、0.24 mol?L-1 |
| B、0.28 mol?L-1 |
| C、0.32 mol?L-1 |
| D、0.26 mol?L-1 |
查看答案和解析>>
科目: 来源: 题型:
| A、当v正(A)═2v逆(C)时,可断定反应已达平衡 |
| B、起始时刻和达平衡后容器中的压强比为 1:1 |
| C、物质A、B的转化率之比为1:2 |
| D、若起始时放入2molA和2amolB,则达平衡时生成2bmolC |
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.
甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com